
神経炎症研究
- プロスタグランジンD2(PGD2)は、睡眠誘発作用とともに、強力な炎症メディエータ作用をもつ生理活性物質です。我々は、PGD2を介した神経炎症が神経発達にどのような影響を与えるのかを研究しています。
- 自閉スペクトラム症は「社会性およびコミュニケーションの障害」「限定された興味・想像力の障害」をその中核症状としますが、樹状突起棘が定型発達者に比し多い(Hutsler and Zhang. 2010)ことから、樹状突起棘の刈り込み異常とそれに起因する神経回路の異常がその本態と示唆されています。実際我々は、ヒトにおいて遠隔部位を接続する神経線維束の発達不全など、神経回路構築の異常について報告しています。自閉スペクトラム症(ASD)の発症原因のうち遺伝子異常の関与が同定されるケースは全体の数%にすぎず、環境要因がクローズアップされています。環境要因のなかでは自閉症発症のオッズ比をあげるものとして、胎児期の感染、および出生直後の神経炎症を引き起こす低酸素イベントなどが注目されており(Gardener et al. 2011)。さらに、ASD脳において脳における炎症担当細胞であるミクログリアが増加していること(Morgan et al. 2010, Nakamura et al. 2014)が示され、神経炎症機序がASD発症に関与していることが大きな注目を集めています。神経炎症の主役であるミクログリアはシナプスを調節すること(Bessis et al. 2007)、樹状突起棘を刈り込むこと(Paolicelli et al. 2011, Shafer et al. 2012)など、ミクログリアのシナプス調節への直接関与が報告されています。しかしながら①神経炎症機転が実際にどのように自閉症脳の神経回路形成に影響を与えるのか、②自閉症は胎内で病的プロセスが進行する先天性の脳障害にもかかわらず、なぜ死後脳や成人でもミクログリアが活性化しているのかその慢性に炎症が持続する機序についてはまだ不明です。
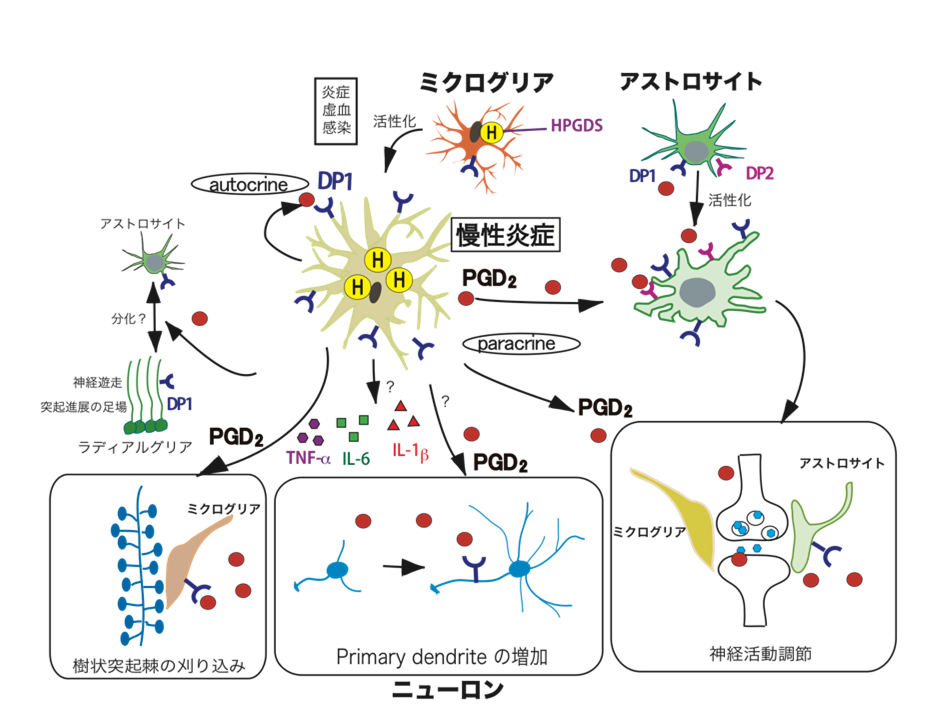
- 我々は、マウスモデルを用い、進行性脱髄疾患であるクラッベ病、アルツハイマー病、脳性麻痺の原因である新生児低酸素性虚血性脳症、脊髄損傷など様々な疾患で活性化ミクログリアが造血器型プロスタグランジンD合成酵素(HPGDS)を発現し、炎症増悪に関与していることを報告。HPGDS阻害剤投与により炎症を抑制し、疾患の進行を阻害できることを報告しました。さらに、米国Autism Tissue Program から提供を受けた死後脳を用いた研究で、ASD脳ではHPGDS陽性ミクログリアがコントロールに比べ、小脳やBA9というASD症状に関連する脳部位において有意に増加していることを確認しています。(投稿準備中)。さらに、幼若期に活性化したミクログリアがHPGDSを強発現していること、マウス胎児脳からの初代培養神経細胞にPGD2受容体アゴニストを作用させると樹状突起の数が変化することなど、マウスモデルを用いてPGD2を介した神経炎症が脳発達にどのように影響するかの研究を進めています。また、これらの知見に基づいて、ヒトiPS細胞を用いた自閉症脳の病態への神経炎症の関与についても研究を行っています。
- 業 績
発達障がいのゲノム研究
- 発達障がいには遺伝的な要因も関与しています。ただ、一つの遺伝子の変化によって説明できる発達障がいはほんの一部に過ぎず、発達障がいの患者さんの血液や唾液からDNAを抽出し、ゲノム解析を行って発達障がいのリスクとなる遺伝子の同定、遺伝的背景による症状の違いなどを研究しています。
↑


